1.脂质体概述
1965年,英G学者Bangham和Standish将磷脂分散在水中进行电镜观察时发现了脂质体。磷脂分散在水中自然形成多层囊泡,每层均为脂质的双分子层;囊泡中央和各层之间被水相隔开,双分子层厚度约为4纳米。后来,将这种具有类似生物膜结构的双分子小囊称为脂质体。此两位学者曾获得过诺贝尔奖提名。
某些磷脂分散在过量的水中形成了脂质体,该脂分子本身排成双分子层,在磷脂的主要相变温度(Tm)以上,瞬间形成泡囊,且泡囊包围水液,根据磷脂种类及制备时所用温度,双分子层可以是凝胶或液晶状态。在凝胶态时磷脂烃链是一种有规律的结构,在液态时烃链是无规律的
,每一种用来制备脂质体的纯磷脂由凝胶状态过渡到液晶状态时均具有特征的相变温度。这种相变温度(Tin)是根据磷脂性质而变(见下表),它可在-20~+90℃之间变化,双分子层的不同成分混合物可引起相变温度的变化或相变完全消失,当双分子层通过相变温度时,被封闭的水溶性标示物的漏出量增加。
|
磷脂种类 |
相变温度(℃) |
|
卵磷脂(卵磷脂胆碱) |
-15—7 |
|
脑磷脂酰丝氨酸 |
6—8 |
|
二棕榈磷脂 |
41 |
|
氢化大豆磷脂 |
51 |
脂质体的相变行为决定了脂质体的通透性、融合、聚集及蛋白结合能力,所有这些都明显影响脂质体的稳定性和它们在生物体系中的行为。
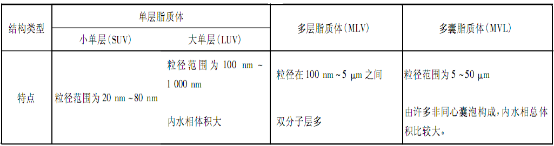
脂质体根据其脂质膜的层数和腔室的数量,可以分为单层脂质体,多层脂质体和多囊脂质体,单层脂质体。不同类型的脂质体其结构特点各不相同,见下图表。
1971年,英GRymen等人开始将脂质体用作药物载体。所谓载体,可以是一组分子,包蔽于药物外,通过渗透或被巨嗜细胞吞噬后载体被酶类分解而释放药物,从而发挥作用。它具有类细胞结构,进入动物体内主要被网状内皮系统吞噬而激活机体的自身免疫功能,并改变被包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高药物的治疗指数,减少药物的治疗剂量和降低药物的毒性。脂质体技术是被喻为“生物导弹”的第四代靶向给药技术,也是目前G际上**热门的制药技术。**于药物在脂质体中的负载定位,其取决于所载药物的性质,见下图。
 2.脂质体制备方法分类及其介绍
2.脂质体制备方法分类及其介绍
脂质体是由磷脂分子在水相中通过疏水作用形成的,因此制备脂质体所强调的不是膜组装,而是如何形成适当大小、包封率高和稳定性高的囊泡。制备的方法不同,脂质体的粒径可从几十纳米到几微米,并且结构也不尽相同。
目前,制备脂质体的方法较多,常用的有薄膜法、反相蒸发法、溶剂注入法和复乳法等,这些方法一般称为被动载药法,而pH梯度法,硫酸铵梯度法一般被称为主动载药法。
2.1被动载药法
脂质体常用制备方法主要有薄膜分散法、反相蒸发法、注入法、超声波分散等。在制备含药脂质体时,shou先将药物溶于水相或有机相中,然后按适宜的方法制备含药脂质体,该法适于脂溶性强的药物,所得脂质体具有较高包封率。
2.1.1 薄膜分散法
此法**初由Bangham 等报道,是**原始但又是迄今为止**基本和应用**广泛的脂质体的制备方法。将磷脂和胆固醇等类脂及脂溶性药物溶于有机溶剂,然后将此溶液置于一大的圆底烧瓶中,再旋转减压蒸干,磷脂在烧瓶内壁上会形成一层很薄的膜,然后加入一定量的缓冲溶液,充分振荡烧瓶使脂质膜水化脱落,即可得到脂质体。这种方法对水溶性药物可获得较高的包封率,但是脂质体粒径在0.2~5 μm 之间,可通过超声波仪处理或者通过挤压使脂质体通过固定粒径的聚碳酸酯膜,在一定程度上降低脂质体的粒径。
2.1.2 超声分散法
将磷脂、胆固醇和待包封药物一起溶解于有机溶剂中,混合均匀后旋转蒸发去除有机溶剂,将剩下的溶液再经超声波处理,分离即得脂质体。超声波法可分为两种“水浴超声波法和探针超声波法”,本法是制备小脂质体的常用方法,但是超声波易引起药物的降解问题。
2.1.3 冷冻干燥法
脂质体混悬液在贮存期间易发生聚集、融合及药物渗漏,且磷脂易氧化、水解,难以满足药物制剂稳定性的要求。1978 年Vanleberghe 等**报道采用冷冻干燥法提高脂质体的贮存稳定性。目前,该法已成为较有前途的改善脂质体制剂长期稳定性的方法之一。
脂质体冷冻干燥包括预冻、初步干燥及二次干燥 3 个过程。冻干脂质体可直接作为固体剂型,如喷雾剂使用,也可用水或其它溶剂化重建成脂质体混悬液使用,但预冻、干燥和复水等过程均不利于脂质体结构和功能的稳定。如在冻干前加入适宜的冻干保护剂,采用适当的工艺,则可大大减轻甚**消除冻干过程对脂质体的破坏,复水后脂质体的形态、粒径及包封率等均无显著变化。单糖、二糖、寡聚糖、多糖、多元醇及其他水溶性高分子物质都可以用做脂质体冻干保护剂,其中二糖是研究**多也是**有效的,常用的有海藻糖、麦芽糖、蔗糖及乳糖。本法适于热敏型药物前体脂质体的制备,但成本较高。陈建明等以大豆磷脂为膜材,以甘露醇为冻干保护剂,采用冻干法制备了维生素A前体脂质体,复水化后平均粒径为0.6151μm ,包封率 98.5%。林中方等采用冻干法制备了鬼臼毒素体脂质体,复水化后平均粒径为 1.451μm ,包封率 72.3%,但是这种方法仍然存在着不足之处,例如脂质体复水化后粒径分布不够均匀。#p#分页标题#e#
2.1.4 冻融法
此法shou先制备包封有药物的脂质体,然后冷冻。在快速冷冻过程中,由于冰晶的形成,使形成的脂质体膜破裂,冰晶的片层与破碎的膜同时存在,此状态不稳定,在缓慢融化过程中,暴露出的脂膜互相融合重新形成脂质体。何文等分别用反相蒸发法、乳化法和冻融法制备了甲氧沙林脂质体。通过研究发现,冻融法制备的脂质体的包封率**高,但是粒径**大。反复冻融可以提高脂质体的包封率,**健松制备了阿奇霉素脂质体,实验发现,经3次重复冻融后,阿奇霉素脂质体的包封率从61.4% 增加到78%,但是当冻融次数增加到4次,包封率变化很小。该制备方法适于较大量的生产,尤其对不稳定的药物**适合。
2.1.5 复乳法
此法第1步将磷脂溶于有机溶剂,加入待包封药物的溶液,乳化得到W/O 初乳,第2步将初乳加入到10倍体积的水中混合,乳化得到W/O/W乳液,然后在一定温度下去除有机溶剂即可得到脂质体。Kim用乳化法制得脂质体的包封率比较高,但是粒径较大。Tomoko等通过研究发现,第2步乳化过程和有机溶剂的去除过程的温度对脂质体的粒径有比较大的影响,较低的温度有利于减小脂质体的粒径,通过控制温度可以制得粒径为400 nm,包封率达到 90%的脂质体。
2.1.6 注入法
将类脂质和脂溶性药物溶于有机溶剂中(油相),然后把油相均速注射到水相(含水溶性药物)中,搅拌挥尽有机溶剂,再乳匀或超声得到脂质体。根据溶剂的不同可分为乙醇注入法和乙醚注入法。
乙醇注入法避免了使用有机溶剂,丁丽燕用乙醇法制备了司帕沙星脂质体,通过研究发现慢速注入可制得具有较高包封率的脂质体,其包封率为47%。
乙醚注入法制备的脂质体大多为单室脂质体,粒径jue大多数在2 μm以下,操作过程中温度比较低(40℃),因此,该方法适用于在乙醚中有较好溶解度和对热不稳定药物,同时通过调节乙醚中不同磷脂的浓度,可以得到不同粒径且粒径分布均匀的脂质体混悬液。
2.1.7 反相蒸发法
**初由Szoka提出,一般的制法是将磷脂等膜材溶于有机溶剂中,短时超声振荡,直**形成稳定的W/O乳液,然后减压蒸发除掉有机溶剂,达到胶态后,滴加缓冲液,旋转蒸发使器壁上的凝胶脱落,然后在减压下继续蒸发,制得水性混悬液,除去未包入的药物,即得大单层脂质体脂质体。此法可包裹较大的水容积,一般适用于包封水溶性药物、大分子生物活性物质等。
2.1.8 超临界法
传统的脂质体制备方法,必须要使用氯仿
、乙醚、甲醇等有机溶剂,这对环境和人体都是有害的。超临界二氧化碳是一种无毒、惰性且对环境无害的反应介质。严宾等用超临界法制备了头孢唑林钠脂质体,将一定量的卵磷脂溶解于乙醇中配得卵磷酯乙醇溶液,与头孢唑啉钠溶液一起放入加入高压釜中,将高压釜放入恒温水浴中,通入CO
2。在其超临界态下孵化30min,制备脂质体。采用超临界CO
2法制备的包封率高、粒径小,稳定性增强。
2.2 主动载药
对于两亲性药物,如某些弱酸弱碱,其油水分配系数介质pH和离子强度的影响较大,用被动载药法制得的脂质体包封率低。
主动载药是利用两亲性的药物,能以电中性的形式跨越脂质双层,但其电离形式却不能跨越的原理来实现的。通过形成脂质体膜内、外水相的pH梯度差异,使脂质体外水相的药物自发地向脂质体内部聚集。
此法通常用脂质体包封酸性缓冲盐,然后用碱把外水相调成中性,建立脂质体内外的pH 梯度。药物在外水相的pH环境下以亲脂性的中性形式存在,能够透过脂质体双层膜。而在脂质体内水相中药物被质子化转为离子形式,不能再通过脂质体双层回到外水相,因而被包封在脂质体中。主动载药法广义上就是指pH 梯度法。人们把其细分为:(1)pH梯度法;(2)硫酸铵梯度法;(3)醋酸钙梯度法。其中硫酸铵梯度法和醋酸钙梯度法只是pH梯度法的两种特殊形式。
2.2.1 pH梯度法
pH梯度法通过调节脂质体内外水相的pH值,形成一定的pH梯度差,弱酸或弱碱药物则顺着pH梯度,以分子形式跨越磷脂膜而使以离子形式被包封在内水相中。
赵妍等用以pH梯度法制备硫酸长春新碱脂质体,其包封率大于85%,而被动载药法制备的硫酸长春新碱脂质体的包封率**高为14.4%。Jia等用pH梯度法内水相pH 0.5%外水相pH4.0制备了卡苯达唑脂质体,包封率高于95%。杜松等用pH梯度法制备盐酸去氢骆驼蓬碱脂质体,包封率大于80%,研究表明,虽然制得的脂质体没有加强药物的抗癌活性,但是大大降低了其毒副作用。
跨膜pH梯度是影响包封率的**主要因素,通常pH梯度越大,载入脂质体内的药物越多,包封率也越高。制备伊立替康脂质体时,当pH梯度≥3.7时包封率达97%以上,当pH梯度<2时,包封率不到5%;Mamyer等在研究中发现通过跨膜pH梯度法制备多柔比星脂质体,pH梯度达到3.5时包封率达98%,降低内水相缓冲液的pH可增大pH梯度,但会加剧磷脂的水解,降低脂质体的稳定性。#p#分页标题#e#
此外,药物自身性质如油水分配系数、膜渗透性等亦可影响包封率。Quan等用pH梯度法制备多巴胺脂质体,由于多巴胺亲水性较强,无法直接克服能量壁垒穿过脂质双分子层进入内水相,但与拉沙洛西(lasalocid)结合形成复合物可暴露出亲脂性表面,即可穿过脂质膜进入脂质体,包封率提高到85%。氧化苦参碱水溶性较大,脂溶性较弱,因此采用pH梯度法制备脂质体包封率只有50%。
2.2.2 硫酸铵梯度法
硫酸铵梯度法通过游离氨扩散到脂质体外,间接形成pH梯度,使药物积聚到脂质体内。其方法为先将硫酸铵包与脂质体内水相,然后通过透析、凝胶色谱或超滤的方法除去脂质体外水相的硫酸铵。由于离子对双分子层渗透系数的不同,氨分子渗透系数(0.13 cm/s)较高,能很快扩散到外水相中;H
+的渗透系数远小于氨分子,因此会使脂质体内水相呈酸性,形成pH梯度,梯度大小由[NH
4+]外水相/[NH
4+]内水相比较决定,这样使药物逆硫酸铵梯度载入脂质体。药物与SO
42-形成的硫酸盐,对双分子层有很低渗透系数,因而使药物具有很高的包封率。
刘陶世等采用硫酸铵梯度法制备马钱子碱脂质体 ,0.1 mol/L硫酸铵水溶液的用量为大豆卵磷脂的66.7倍,制得的马钱子碱脂质体包封率在90%以上。米托恩醌以注入法或反相蒸 发法制备的脂质体,包封率较低,但是其为弱碱性蒽醌类药物,易与硫酸根离子形成溶解性更小的硫酸盐,黄园用硫酸铵梯度法制备米托蒽醌脂质体的平均粒径均在60 nm左右,包封率为93.65%。Pan 等用不同的主动载药法制备了5种多铵硼酸盐脂质体,得到较高的包封率仅为6%和15%。研究表明,用硫酸铵梯度法制备的脂质体包封率要高于枸橼酸盐pH梯度法制得的脂质体。Wong等用此法制备了环丙沙星单室脂质体,包封率为90%。相比较于pH梯度法,硫酸铵梯度法不需要改变外水相的pH值,控制梯度也易实现,整个过程无需缓冲液或pH滴定,内水相只有pH梯度法更有利于脂质体的稳定。
2.2.3 醋酸钙梯度法
醋酸钙梯度法通过醋酸钙的跨膜运动产生的醋酸钙浓度梯度(内部的浓度高于外部),使得大量质子从脂质体内部转运到外部产生pH梯度。醋酸的渗透参数(6.6×10
-4cm·s
-1)比Ca
2+(2.5×10
-11cm·s
-1)大7个数量级,所以很少穿越双分子膜留在脂质体内部,醋酸分子则参与了质子转运。醋酸钙跨膜运动产生的浓度梯度(内部的浓度高于外部)导致大量质子从脂质体的内部转运到外部产生pH梯度,而pH的不平衡为包载和聚集弱碱药物提供了高效驱动力。因此,在这基础上应用醋酸钙梯度法把弱酸药物萘啶酸包载入预制备好的空白脂质体中,包封率约99%,在4℃下存放10个月均稳定未见泄露。Hwang等也用此法制备了双氯芬酸钠脂质体,包封率约100%,而传统的逆相蒸发法只有1%~8%。
2.3 不同的制备方法与脂质体的结构关系
上述制备方法的分类是按照载药方式的不同来分的,倘若将这些制备方法进行一个总结与归纳,不难得出,这些方法一般包括以下步骤:shou先形成脂质薄膜,其次,加入需要载入的药物,使脂质分散在其中,从而形成脂质体。各种方法的区别在于脂质分散与水相介质的方法不同。各种方法的分散类型可以归纳为机械分散法(如薄膜分散法、手摇法、前体脂质体法、冷冻干燥法等),溶剂分散法(如逆向蒸发法、注入法、复乳法等),物理水化法(如超声法、薄膜振荡分散法、薄膜匀化法、挤压法、干燥重建脂质体和微囊化法、冻结融解法等)及其他方法(如梯度法、表面活性法等)。
采用不同的制备方法得出来的脂质体其结构与大小各不相同,一般来说,采用机械分散法得到的脂质体大多是多层脂质体,采用逆向蒸发法得到的是大单层脂质体,乙醇注入法中小单层脂质体比例较高,而乙醚注入法中大单层脂质体较多,复乳法得到的脂质体往往是多囊脂质体。
3.脂质体制备方法的选择
3.1脂质体制备方法的选择原则
选用何种脂质体制备方法取决于所要包裹的药物的性质,其中**主要的性质就是药物的油水分配系数。
油水分配系数是指平衡状态时,药物在油相和水相的分配之比。一般使用药物在辛醇—水两相的分配系数P来表示。根据P值的大小将药物分成三类:
LgP>4.5 脂溶性药物
LgP<-0.3 水溶性药物
-0.3<LgP<4.5 两性药物
对于不同类药物脂质体的制备方法选择原则如下图:
 3.2脂质体生产制备中的实际选择
3.2脂质体生产制备中的实际选择
许多脂质体制备技术是以实验室规模进行的,但这些小规模的制备技术不能直接用于大规模制备生产中,因为生产规模的变化会影响其分散性,改变制备分散体系的特性应保持在可接受的一定范围限度内,即包封药物的脂质体在体内处于无显著变化为准则。其次,在脂质体大规模生产制备过程中还得考虑实际的无菌、无热源,粒径的控制、稳定性以及工艺便于放大等等实际问题。
从查阅的G内外脂质体制备文献上来看,目前对于大规模生产脂质体方法上大多是根据设施设备条件结合两三中脂质体制备方法来实现脂质体的生产制备,如SOD的生产工艺就是结合了薄膜法和超声法,阿霉素纳米脂质体的制备采用了薄膜分散法和挤压法相结合。#p#分页标题#e#
除了运用常规脂质体制备方法相结合外,在脂质体制备生产中还引入了其他前沿的生物学及化学上的技术。如Aphios 脂质体公司采用超临界流体技术制备纳米级单分散的脂质体。该技术和常规的醇注入技术有类似之处,所不同的是溶解磷脂和胆固醇时用的是超临界流体。采用该技术,Aphios 已经成功的将紫杉醇(paclitaxel), 喜树碱(camptothecin)等难溶性药物制成了脂质体制剂。BernaBiotech公司运用Virosomes 技术已经开发了2 个产品,一个是流感疫苗(Inflexal. V),一个是甲肝疫苗(Epaxal.)。Virosomes 与传统脂质体的区别主要在于,Virosomes 的磷脂双分子层上嵌入了病毒的膜蛋白。这些蛋白可以保证Virosomes 和免疫系统的细胞发生融合,进而将其所包被的特异性抗原递呈给免疫细胞。Virosomes 不仅可以模拟天然抗原的递呈方式,还可以同时引起体液免疫和细胞免疫,进而增强疫苗的有效性。Celsion 公司采用微波热疗技术相结合,开发阿霉素热敏脂质体ThermoDox.,现已进入1 期临床。
3.3脂质体制备中包封率的影响因素及其提高办法
影响脂质体包封率的因素主要有脂质体制备方法、脂质体结构类型、类脂膜的组成、药物的性质和浓度、溶剂的组成等几大因素。
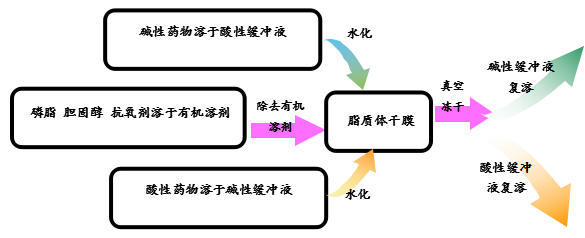
对于提高包封率除了对以上因素进行优化之外,还可以针对所有包载的药物的类型采取下图所示策略来提高其包封率。
 3.3.生物研究中心现有脂质体制备设备可以采用的制备方法及看法
3.3.生物研究中心现有脂质体制备设备可以采用的制备方法及看法
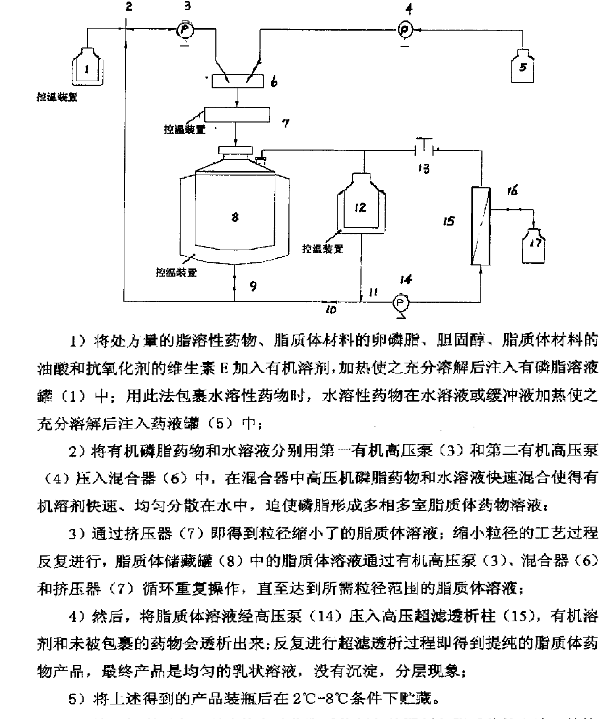
生物研究中心脂质体制备设备可以采用的的制备方法有注入法、复乳法、挤压法及薄膜分散法(包括逆向蒸发法),其中,以注入法和复乳法**利于现有工艺设施的生产放大。只不过,中心现有设备设施中,脂质体制备工艺流程中人为操作的环节过多,不利于工艺生产中的再现性,也不利于无菌的控制。为了能更好地说明此问题,先来看下陕西力邦医药科技有限公司在脂质体生产中所设计和采用的自动化脂质体制备装置,通过装置图及其使用流程说明,不难看出,该装置在脂质体制备过程中使用了分散法和挤压法相结合。利用高压泵提供稳定的压力,整个过程中避免了人员的干扰。
 参考文献
参考文献
郑庆忠,刘利军.pH梯度法制备氧化苦参碱脂质体[J].中G医药工业杂志,2006,37:679.
刘陶世,蔡宝昌,赵新慧,等.硫酸铵梯度法结合微滤挤出制备马钱子碱脂质体的研究[J].中成药,2005,11:1247.
黄园,段逸松.硫酸铵梯度法制备米托蒽醌脂质体[J].中G药学杂志,2002,12:917.
陈建明,张仰眉,高申,等.维生素A前体脂质体的研制及其特性考察[J].第二军医大学学报,2003,24(2):207.
林中方,曾抗,周再高,等.鬼臼毒素二棕榈酰磷脂酰胆碱前体脂质体的研制及特性观察[J].**军医大学学报,2004,24(7):784.
何文,夏晶.制备方法对甲氧沙林脂质体体外性质的影响研究[J].广东药学院学报,2005,6:661.
**健松,朱家壁.阿奇霉素脂质体的制备及其包封率测定[J].中G药科大学学报,2004,35(6):499.
丁丽燕,杨 春,李学明,等.乙醇注入法制备司帕沙星脂质体[J].南京工业大学学报,2007,1:32.
**健松,朱家壁.乙醚注入法制备阿奇霉素脂体[J].中G药学杂志,2005,6:876.
严宾,安学勤,白 晶,等.超临界CO
2法制备头孢唑啉钠脂质体[J].物理化学学报,2006,2:226.
赵妍,于彬,邓意辉卜,等.主动载药法制备硫酸长春新碱脂质体及其包封率的测定[J].中G药学杂志,2005,10:1559.
杜松,邓英杰,张 威.主动载药法制备盐酸去氢骆驼蓬碱脂质体[J].中草药,2005,5:673.
陈涛,**九成,付经G,等. 脂质体药物制剂的研究现状和前景[J]. 世界**新医学信息文摘, 2003, 2(4):721-728.
郭青龙,丁启龙. 阿霉素前体脂质体与阿霉素对小鼠毒性作用比较[J]. 中G药科大学学报,1996,27(9):562-566.
**九成,慧民全,陈涛 CP 02139429.6
Gabizon AA, Liposomal drug carrier systems in cancer chemotherapy: Current status and future prospects[J]. J Drug Target,2002,10:535-538.
Frezard F, Santaella C, Montiscin MJ, et al. Fluorinated phosphatidylcholinebased liposomes: H+/Na+ permeability,active doxorubicin encapsilation and stability, in human serun[J]. Biochim Biophys Acta, 1994, 1194: 61-68.
Wang RT, Chen T, Wang Z, et al. AcidSensitive polymer liposomes prepared by poly(2ethylacrylic acid) alkylamide derivatives[J].Acta Pharmacol Sin, 2007, 42(12): 2-7.
Kim S,Martin G M.Preparation of cell-size unilamellar liposomes with high captured volume and defined size distribution [J].Biochim Biophys Acta,1983,728:339.
Tomoko Nii,Akira Takamura,Kiminori Mohri,et al.Fcators affecting physicochemical propertise of liposomes prepared with hydrogenated purifide egg yolk lecithins by the microencapsulation vesicles method[J].colloida and Surfaces B:Biointerfaces,2002:323.
Jia L,Garza M,Wong H,etal.Pharmacokonetie comparison of intravenous carbendazim and remote loaded carbendazim lipesomes in nude mice[J].J Pharm Biomed Anal,2002,28(1):65.
Chou TH,Chen SC,Chu IM.Effect of composition on the stability of liposomal irinotecan prepared by a pH gradient method [J].J Biosci Bioeng,2003,95(4):405.#p#分页标题#e#
Mayer LD,Tai LCL,Bally MB,teal.Characterization of liposomal system containing doxorubicin entrappde in response to pH gradients [J].Biochim Biophys Acta,1990,1025(2):143.
Quan z,Sugawara M,Umezawa Y.Lasalocid .Afacilitated dopamine uphill transport and concentration into liposomes driven by pH gradient generated by bacteriorhodopsin under illumination[J].Biosens Bioelectron,1998,13(11):1157.
Pan XQ,Wang H,Shukla S,et al.Boron-containing folate receptor targeted liposomes as potential delivery agents for neutron capture therapy[J].Bioconjugate Chem,2002,13:435.
Wong JP,Yang H,Blasetti KL,et al.Liposome delivery of ciprofloxacin against intracellular Francisellatularensis infectin[J].J Controlled,2003,92(3):265.
Clerc S, Bareubolz Y.Loading of amphipathic weak acids into liposomes in response to transmembrane calcium acetate gradients [J].Biochim Biophys Acta,1995,1240:257.
Hwang SH,Maitani Y.Remote loading of diclofenac, insulin and fluorescein isothiocyanate labeled insulin into liposomes by pH and acetate gradient methods [J]Int. J. Pharm, 1999, 179:85.
陈阶
2013年2月26日定稿




